
여러분이 사용하는 수많은 전자 기기들, 그 많은 전자제품들을 전기 코드도 꽂지 않고 사용할 수 있는 이유는 무엇일까요? 바로, 배터리입니다. 그렇다면 배터리를 만드는 가장 중요한 물질인 리튬에 대해서는 얼마나 알고 계신가요? 저와 함께 알아볼까요?
01
리튬, 무엇일까?

리튬(Lithium)은 원자번호 3번, 원자량 6.941u*를 가지는 금속 중 가장 가벼운 물질입니다. 주기율표 상 제 1족으로서 나트륨, 칼륨과 비슷한 성질을 가지고 있습니다. 리튬의 이름은 돌을 뜻하는 그리스어 리토스(λίθος)에서 유래하였는데, 이는 리튬이 광석에서 처음 발견되었기 때문입니다. 지구 지각의 약 0.006%정도가 리튬이며, 전체 리튬의 약 87%는 염호**에 매장되어 있습니다.
*u : 원자질량단위(unified atomic mass unit)
**염호(鹽湖): 바닷물보다 짠물이 고인 호수
02
리튬, 어떻게 얻을까?

리튬을 채취하는 법은 크게 광물에서 분리 정제 하는 방법과 염호의 염수를 증발시켜 나오는 소금덩어리를 정제하는 방법으로 나뉩니다. 광물 정제 방식은 호주에서 많이 사용되고 있습니다. 리튬 함량이 높은 스포듀민(Spodumene)*정광**을 채굴하여 정제하는 방식이죠.
염호에서 채취하는 방식은 남아메리카에서 많이 쓰입니다. 대표적인 리튬 채취 염호는 거울과 같은 풍경으로 유명한 볼리비아 우유니 소금 사막, 칠레의 아타카마 염호 등이 있습니다. 현재 연간 리튬 생산량의 60%이상이 남아메리카의 염호에서 생산되고 있으며, 생산방식의 편리함과 증가하는 리튬 수요로 인해 염호 생산이 앞으로 더 각광받을 것으로 보입니다.
*스포듀민: 리튬의 공급원이 되는 광석광물
**정광: 채굴된 광석에서 불순물을 제거해 공업원료로 직접 사용할 수 있을 정도로 품위를 높인 광석
03
리튬, 어떻게 정제할까?
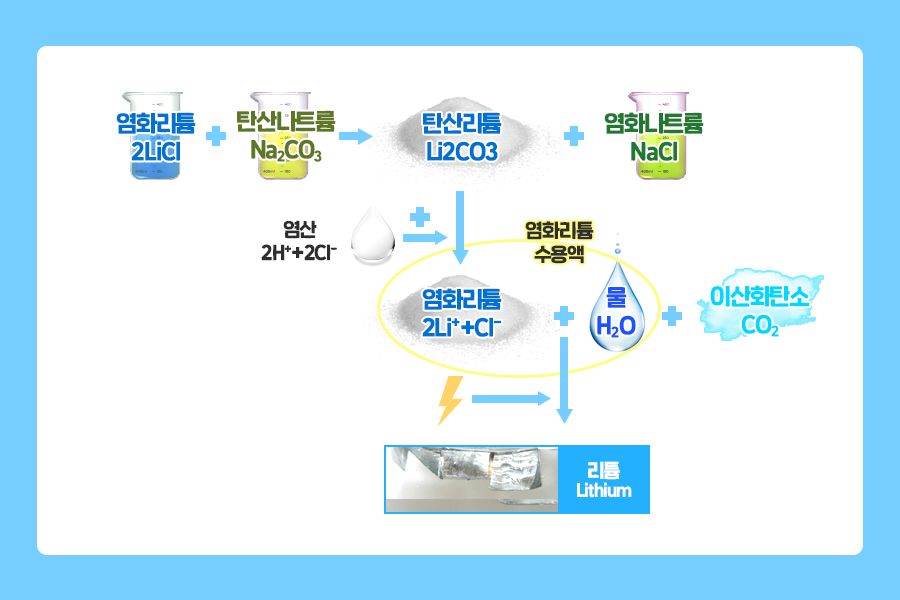
염호에서 바로 순도 높은 리튬을 얻을 수 있는 것은 아닙니다. 여러 과정이 필요하죠. 먼저, 염화리튬과 염화나트륨이 혼합된 염호의 소금물에 탄산나트륨을 첨가합니다. 그러면 물에 잘 녹지 않는 탄산리튬의 형태로 침전되어 쉽게 분리가 가능해집니다.(1)
이렇게 분리된 탄산리튬은 염산과 반응시켜 염화리튬 수용액으로 만듭니다.(2) 그 다음, 이 수용액에 전기를 흘려 전기분해를 하게 되면 깨끗한 리튬 금속을 얻을 수 있답니다.(3)
(1) 2 LiCl (aq) + Na2CO3(aq) → Li2CO3↓(s) + NaCl (aq)
(2) Li2CO3(s) + 2H+ + 2Cl- → 2Li+ +Cl- + CO2 (g) +H2O
(3) Li+ + Cl- → Li(metal) + Cl2(g) (전해질을 이용한 전기분해)
04
리튬, 어디에 쓰일까?

1800년대 초 처음 모습을 드러낸 리튬. 현대에 리튬은 하얀 석유라고 불릴 만큼 중요한 쓰임새를 가지고 있습니다. 먼저, 리튬은 유리의 첨가제로 사용됩니다. 유리에 리튬 광물을 첨가하게 되면 유리의 용융* 온도를 낮추어 에너지 비용을 낮출 수 있고, 유리의 품질 및 내열성을 개선할 수 있습니다.
또 리튬은 정신질환의 치료제로 사용됩니다. 1940년대 호주의 정신의학자 존 케이드는 기니피그를 대상으로 한 실험에서 처음으로 탄산리튬의 정신의학적 효과를 발견했습니다. 탄산리튬을 투여받은 기니피그가 멍한 표정으로 케이드를 쳐다봤다고 하네요. 그 이후 정신과 의사인 모겐스 쇼우가 탄산리튬이 조울증 치료에 효과가 있다는 사실을 밝혀내면서 리튬은 양극성장애의 치료에 널리 사용 되고 있습니다.
*용융 : 고체에 열을 가해 액체가 되는 현상
05
리튬, 어디에 쓰일까?

리튬은 트리튬(Tritium, 삼중수소)의 원료로도 사용됩니다. 트리튬은 일반적인 수소에 중성자가 2개 더 붙어있는 물질 입니다. 트리튬은 리튬을 이용하여 만들어 만들어지는데요. 리튬-6 (원자량 6인 리튬)을 중성자와 반응시키면 헬륨과 방사성을 띄는 트리튬이 만들어집니다. 트리튬에서 나오는 방사선이 인(phosphorous)과 만나면 형광을 나타내게 됩니다. 트리튬의 반감기는 12년 정도이기 때문에, 트리튬이 사용된 시계는 수십년동안 야광을 나타내게 됩니다.
마지막으로 리튬이 쓰이는 곳은 바로 ‘리튬이온배터리’입니다. 리튬은 리튬이온배터리 원가의 40% 수준을 차지하는 배터리 양극재 및 전해액으로 사용됩니다. 배터리의 핵심소재라고 할 수 있죠. 충전이 가능하기 때문에 모바일 기기가 많아지면서 사용량이 증가하였고, 최근 범세계적으로 내연기관차에서 전기차로의 전환이 이루어짐에 따라 그 사용량이 폭발적으로 증가하고 있습니다.
현재 리튬 생산량의 대부분이 리튬이온배터리에 사용됩니다. 양극재로 사용될 때는 다른 금속(니켈, 코발트, 망간, 알루미늄 등)과 배합된 산화물로서 사용되고 있습니다. 전해액으로 사용될 때는 전해액 염*으로 육불화인산리튬(LiPF6)를 사용합니다.
*전해액 염: 전해액은 염(salt), 용매(solvent), 첨가제(additive)로 이루어져 있는데, 리튬이온이 이동할 수 있는 통로 역할을 하는 것을 전해액 염이라고 함.
오늘은 최근 가장 화두가 되고 있는 원소인 리튬에 대해 설명 드렸습니다. 어떻게 보면 생소할 수 있지만, 리튬은 우리 생활과 아주 밀접하고 필수적인 물질입니다. 앞으로도 다양한 원소에 대해 여러분께 소개시켜드릴 기회가 있으면 좋겠습니다.
(글: 한화토탈에너지스 촉매연구팀 이승엽 과장)
종합 케미칼 & 에너지 리더,
한화토탈에너지스에 대해 더 알고 싶다면?



'ChemiLOG' 카테고리의 다른 글
| [월간화학] 생분해성 플라스틱 시대의 도래 2 (0) | 2023.01.03 |
|---|---|
| [월간화학] 생분해성 플라스틱 시대의 도래 1 (0) | 2023.01.03 |
| 크리스마스 케빈의 트랩 속 화학 (0) | 2022.12.08 |
| [월간 화학] 커피 한잔 속 카페인 함량은 어떻게 잴까? (0) | 2022.12.02 |
| 화학의 사색: 물리·유기·무기·분석화학 (0) | 2022.11.15 |




