
안녕하세요, 한화토탈 블로그 지기입니다. 전기 없는 세상은 이제 상상하기 힘든데요. ‘배터리(전지) 없는 세상’은 어떨까요? 전선 없이 전기를 쓸 수 있게 하는 전지가 없다면, 지금처럼 스마트폰 같은 휴대용 전자기기를 마음껏 사용할 수 없었을 텐데요. 최근 전기자동차까지 급부상하면서 전지의 중요성은 날로 더 커지고 있습니다.
오늘 다룰 과학의 법칙은 바로, 전자기기에는 없어선 안될 화학전지의 원리에 대해 알아보겠습니다!
01
동물이 전기를 만든다 vs 금속이 전기를 만든다

전선 없이 전기를 쓰려면, 전기를 만드는 방법을 알아야겠죠. 우리가 사용하는 전지는 화학에너지를 기반으로 전기를 발생하는 장치인데요. 지금으로부터 약 230여 년 전, 이탈리아의 의학자 루이지 갈바니(1737~1798)가 전지 발명의 단서가 되는 큰 발견을 하게 됩니다.
갈바니는 철책에 매단 개구리 뒷다리에 철사를 대면 경련이 일어나는 것을 보고, 개구리 자체에서 전기가 나온다고 생각했습니다. 갈바니는 이를 ‘동물전기’라고 이름 붙여 세상에 발표했는데요. 하지만, 이 주장에 대해 이탈리아의 물리학자 알레산드로 볼타(1745~1827)는 다른 주장을 내세웁니다.
볼타는 전기가 만들어진 원인이 개구리의 ‘동물전기’가 아니라, 개구리를 두고 맞닿은 두 금속 사이에 발생한 ‘금속전기’라는 주장을 하는데요. 둘은 20년 동안이나 이를 두고 논쟁을 하게 됩니다.
02
전류는 흐르는 것! 볼타의 전기더미
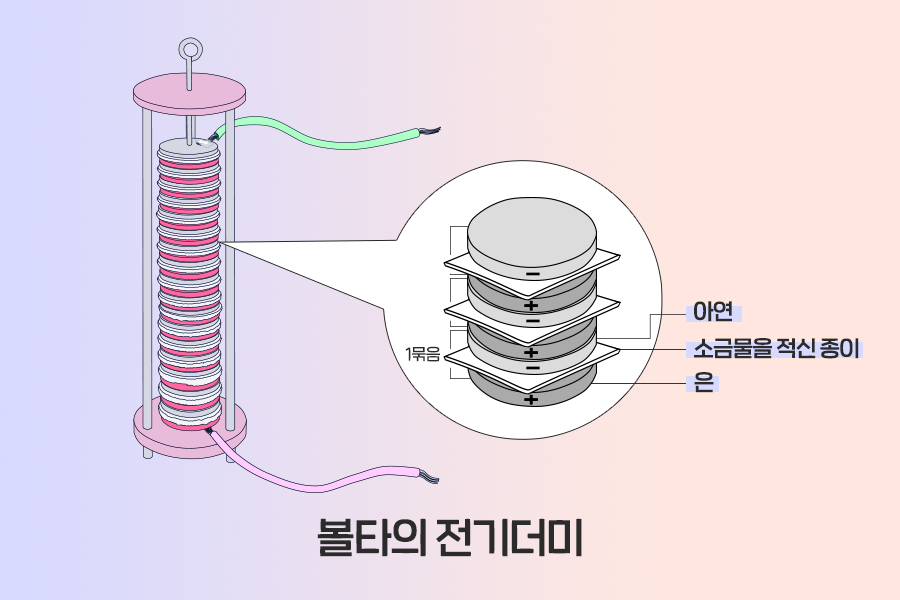
볼타는 두 종류의 금속에 전기를 통하게 하는 액체를 놓으면 전기가 만들어질 거라 가설을 세웠는데요. 은판과 아연판 사이에 소금물을 적신 종이를 끼워 겹겹이 쌓아 올려 전기가 흐르는지 실험했습니다. [은/소금물 종이/아연]을 한 묶음으로, 위아래로 서로 다른 금속이 맞닿도록 기둥처럼 쌓아 전선을 연결하니 전류가 흘렀는데요! 볼타는 이 ‘볼타의 전기더미’(voltaic pile)를 만든 업적을 인정받아 귀족 작위와 훈장까지 받게 됩니다.
당시에는 전기 실험을 하려면 전기 발생 장치로 만든 정전기를 모아서 저장한 ‘라이덴 병’을 활용했는데요. 정전기는 쉽게 없어져 본격적인 실험을 하기엔 힘들었습니다. 금속을 이용해 전기를 만드는 방법은 정전기를 모아 사용하는 방법보다 더 오랜 시간, 안정적으로 전기를 사용할 수 있어 이후 전기를 활용한 더 많은 발명을 이끌게 됩니다.
03
더 강한 전류를 만들기 위한 실험, 그리고 발견

볼타의 발견은 여기서 끝이 아닙니다. 볼타는 두 종류의 다른 금속을 산성 용액에 담그고, 잠기지 않은 두 끝을 연결하면 전기가 계속 흐르게 되는 것을 발견했는데요. 이 원리를 이용해 만든 최초의 화학 전지가 바로 ‘볼타 전지’(voltaic cell)입니다. 볼타 전지의 기본이 되는 법칙은 ‘볼타 계열’을 인데요. 오늘날 우리가 말하는 ‘금속의 이온화 경향’으로 확장됐죠.
금속은 전기가 흐르는 수용액에 얼마나 더 잘 녹는지에 따라 볼타 계열이 결정됩니다. 볼타 전지에 사용되는 두 금속의 이온화 경향 차이가 클수록 더 강한 전류가 만들어지는데요. 볼타가 실험했던 금속 중에서는 아연(Zn)과 구리(Cu)가 가장 이온화 경향의 차이가 크죠.
볼타는 이 실험을 토대로 구리와 아연을 황산 용액에 넣어 강한 전류가 만들어지는 ‘볼타 전지’를 선보이게 되죠.
04
최초의 화학전지, 볼타전지의 원리와 한계
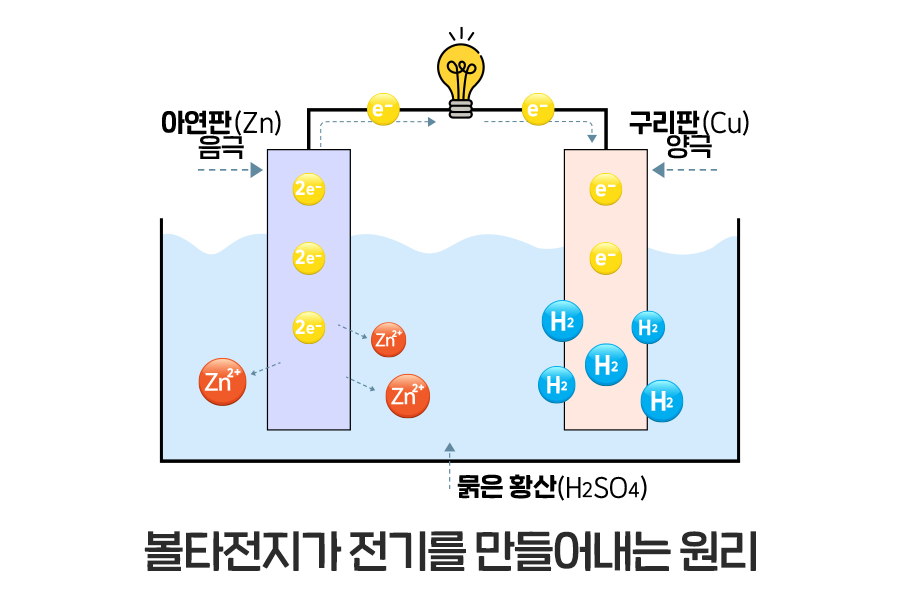
볼타 전지는 어떻게 금속과 산 용액으로 전지를 만들 수 있을까요? 구리(Cu)는 수소(H)보다 이온화 경향이 낮아 산에 녹지 않고, 아연(Zn)은 수소(H)보다 이온화 경향이 높아 산에 녹습니다. 아연은 산에 녹아 양이온(Zn2+)으로 떨어져 나오고, 아연판에 전자(2e-)만 남게 되는데요. 좁은 아연판 속에서 오갈 데 없는 전자들이 전선을 타고 구리판으로 넘어가면서 전기가 통하게 되는 겁니다! 구리판으로 넘어간 전자들은 황산 용액에 남아 있는 수소 이온(H+)과 반응해 수소 기체(H2)가 만들어지면서 아연에서 온 전자는 모든 반응을 마치게 됩니다.
하지만, 볼타전지는 시간이 지나면서 전류가 급격히 약해지고, 아연판이 다 녹기 전에 반응이 멈춰버리는 단점이 있는데요. 바로, 구리판에서 만들어지는 수소 기체가 계속 구리판에 붙어 금속의 화학반응이 지속적으로 일어나는 것을 막기 때문입니다. 이를 ‘분극 현상’이라고 하는데요. 이를 방지하기 위해 전지에 사용되는 두 금속을 각자 다른 수용액에 넣고, 사이에 염다리(salt bridge)를 놓아 화학 반응이 이어지게 한 ‘다니엘 전지’가 등장하게 됩니다.
최초의 화학 전지를 만들어낸 볼타. 18세기 말에서 19세기 초에 등장한 실험실의 화학전지는 이후 19세기 말, 손전등을 밝히며 일상생활에서도 쓸 수 있도록 빠르게 발전했는데요. 이후 재충전이 가능한 2차전지까지 발명되며 오늘날 우리 삶을 더욱 풍요롭게 만들고 있습니다. 전기차 시대가 도래하며 전지의 성능과 안정성에 대한 관심이 높아지고 있는데요. 앞으로 전지가 어떻게 우리 삶을 바꿀지 기대 됩니다!
정수기 원리로 노벨상을 받았다? 반트호프의 법칙
안녕하세요, 한화토탈 블로그 지기입니다. 우리의 일상에서 없어서는 안 되는 소중한 물! 깨끗한 물을 필요할 때 언제든 마시고, 사용할 수 있다는 건 사실 큰 축복인데요. 우리가 일상 속에서
www.chemi-in.com
[과학의 법칙] 맥주는 왜 거품이 나지? 헨리 법칙(Henry's law)
안녕하세요, 한화토탈 블로그 지기입니다. 퇴근 후 시원한 맥주 한잔 만큼 간절한 것은 없죠. 맥주가 가장 생각나는 때는 언제일까요? 일과를 마친 저녁? 친구들과의 만남? 시원하고 청량감 넘치
www.chemi-in.com
종합 케미칼 & 에너지 리더,
한화토탈에 대해 더 알고 싶다면?
'ChemiLOG' 카테고리의 다른 글
| 3D 프린터, 다양한 소재로 무엇이든 출력 가능? (0) | 2021.04.15 |
|---|---|
| K-석유화학은 어떻게 탄생했을까? (0) | 2021.04.14 |
| 알고 가면 더 즐거운 등산용품 속 화학소재 (0) | 2021.04.01 |
| 생활 속 탄소배출 줄이기, 우리 함께 실천해볼까요? (1) | 2021.03.25 |
| 들어는 봤니? 부동액의 원료 에틸렌 글리콜(ETHYLENE GLYCOL) (2) | 2021.03.19 |







