
우리 식탁에서 자주 볼 수 있는 바삭하고 짭조름한 김! 여러분은 김을 구매했을 때 봉지에 든 작고 투명한 실리카 겔 알갱이를 본 적이 있나요?
실리카 겔은 포장지 내의 수분을 빨아들여 김이 바삭바삭하게 유지되도록 도와주는데요. 이렇게 실리카 겔 내에 물 분자가 들어가 붙는 현상을 흡착이라고 합니다. 오늘은 이처럼 우리 실생활에서도 많이 관찰되는 흡착에 대해 알아보겠습니다.
01
흡착이란?

먼저 흡착이란 무엇일까요? 흡착은 기체, 액체, 용해된 상태의 원자, 분자 또는 이온이 고체나 액체 표면에 붙는 과정을 뜻합니다. 흡착이 일어나는 고체를 흡착제라고 하며, 흔히 고체인 흡착제에 기체 분자들이 달라붙는 현상을 흡착이라고 하죠.
흡착되는 분자와 흡착제 표면 사이의 결합 종류에 따라 물리 흡착과 화학 흡착으로 나눌 수 있습니다. 물리 흡착 과정에서는 흡착되는 분자의 전자 구조가 거의 변하지 않고, 반데르발스 힘*에 의한 물리적 결합에 의해 흡착이 일어납니다. 반면에 화학 흡착의 경우 흡착되는 분자나 원자 표면 사이에 화학적 결합이 형성된답니다.
*반데르발스 힘: 중성인 분자에서 극히 근거리에서만 작용하는 약한 인력
02
흡착과 탈착, 환상의 짝꿍

흡착이라고 하면 고체 표면에 분자가 결합하는 것만을 생각하기 쉬운데요, 실제로는 굉장히 빠른 속도로 고체 표면에 흡착한 분자가 떨어져 나가는 탈착 현상도 함께 일어나고 있습니다. 이를 식으로 표현하면 다음과 같습니다.
ΔHads<0
ΔSads<0
ΔGads=ΔHads-TΔSads<0 (온도, 압력 일정)
흡착 과정에서의 엔탈피 변화량(흡착열, ΔHads)은 발열반응이기 때문에 항상 0보다 작습니다. 또한 기체 분자가 고체 표면에 흡착되면 분자 운동의 자유도가 감소하기 때문에 엔트로피(ΔSads)는 감소하게 되죠. 이때 기체 표면의 흡착이 자발적으로 일어나려면 깁스 에너지 변화(ΔGads)가 0보다 작아야 합니다. 따라서 흡착량이 증가하면 ΔHads은 0에 가까워지고, 흡착량 변화에 따라 ΔGads가 0이 되면 흡착과 탈착은 평형에 이르게 됩니다.
조금 어렵죠? 더 쉽게 말하자면, 흡착 속도가 탈착 속도보다 빠를 때는 흡착이 점점 일어나 흡착량이 많아집니다. 그러다가 흡착 평형에 이르면 흡착 속도와 탈착 속도가 같게 되고, 흡착량은 유지되는 것이죠.
▶ 엔탈피, 엔트로피가 궁금하다면?
[쉽게 읽는 과학 3] 열역학 2법칙
앞서 설명한 열역학 제 1법칙은 에너지 보존의 법칙입니다. 에너지는 형태는 변할지 언정 크기는 일정하다는 것이었는데요, 이를 통해서 계 내 외부 간의 열에너지의 흐름과 일, 그리고 내부 에
www.chemi-in.com
03
흡착이 일어나는 과정
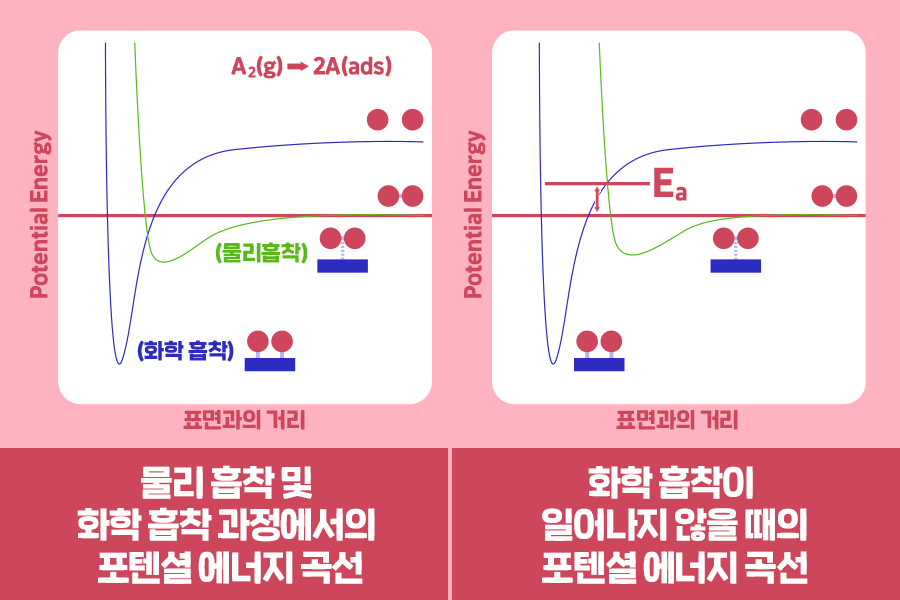
왼쪽 그림은 A2 분자 표면의 흡착과정에서 위치 에너지(potential energy) 변화를 나타내고 있습니다. 먼저, 초록 선을 살펴볼까요? 분자와 흡착제 표면 사이의 거리가 가까워지면 위치 에너지가 낮아지며 A2 분자의 표면은 물리 흡착됩니다. 이때, 표면과의 거리가 더 가까워지면 A 원자의 위치 에너지 곡선을 나타내는 파란 선과 교차하게 되는데, 이 경우 A2 분자가 분해되며 표면에 화학 흡착이 일어납니다.
반면에 오른쪽 그림에서는 초록 선과 파란 선이 교차하는 위치에서의 위치 에너지가 A2 분자로 존재할 때보다 높습니다. 그렇기 때문에 물리 흡착 상태에서 화학 흡착 상태로 가기 위해서는 그 차이만큼의 활성화 에너지(Ea)를 극복해야 하죠. 이 경우에는 활성화 에너지를 뛰어넘는 충분한 에너지를 갖고, 표면에 충돌하는 분자만이 화학 흡착하게 됩니다.
앞선 설명과 같이, 분자가 흡착제에 흡착할 때의 위치 에너지 변화는 흡착제와 분자의 고유한 특성에 따라 다릅니다. 그래서 어떤 흡착제에 어떤 분자를 흡착시키는지에 따라 흡착 정도(흡착량)에 차이가 발생하게 되죠. 흡착 분리 공정에서는 이러한 혼합물의 흡착량 차이를 이용하여 혼합물에서 물질들을 분리하고 있습니다.
04
조건에 따라 달라지는 흡착량

글 내용 메모장에다 복사하고 여기 뒤에 붙이기 /대부분 고체의 표면에서는 어느 정도의 기체 흡착이 일어납니다. 하지만, 다양한 요인에 의해서 흡착량은 달라지죠.
흡착에 영향을 주는 요인으로는 먼저, 흡착제(고체)의 표면적이 있습니다. 같은 조건에서 흡착제의 표면적이 클수록 기체와 접하는 면적(흡착되는 층)이 커지기 때문에 더 많은 양을 흡착할 수 있죠. 따라서 대부분의 흡착제는 표면적을 넓히기 위하여 다공성 구조로 되어 있습니다. 흡착제 중 하나인 탄소 분자체(CMS, carbon molecular sieve)의 경우, 미세공의 크기가 균일하여 특정 크기의 분자만 통과시켜 선택적으로 기체분자를 흡착할 수 있습니다.
흡착량은 기체의 특성에 따라서도 달라질 수 있습니다. 일반적으로 임계 온도*가 높고, 액화가 잘되는 기체일수록 흡착이 잘 되는 것으로 알려져 있는데요. 탄소 분자체와 같이 분자체(Molecular sieve)를 흡착제로 사용하는 경우에는 분자의 크기도 흡착량에 영향을 줄 수 있습니다.
다음으로 흡착량은 흡착이 일어나는 상의 조건(온도, 압력)에도 영향을 받습니다. 흡착제 표면 온도가 낮을수록 흡착되는 기체의 양은 증가하죠. 앞서 말씀드렸듯이 흡착은 발열 반응인데요. 르 샤틀리에의 원리에 의해 온도가 높아질수록 흡착보다 탈착 현상 쪽으로 평형이 이동하여 흡착량이 감소하게 되는 것입니다. 압력의 경우 기체의 압력이 높을수록 단위 시간당 고체 표면에 충돌하는 기체 분자 수가 증가하며 흡착량이 증가합니다. 이렇게 온도와 압력에 따라 흡착량이 변화하는 특성을 이용하여 혼합된 기체를 분리하는 공정을 흡착 분리 공정이라고 합니다.
*임계 온도: 열역학에서 액체와 기체의 상평형이 정의될 수 있는 한계 온도로 액화가 가능한 최고의 온도를 의미
▶ 르 샤틀리에 법칙이란?
[과학의 법칙] 오늘날 화학 공법의 필수! 르 샤틀리에 법칙 알아보기
안녕하세요, 블로그 지기입니다. 세상에는 많고 많은 과학의 법칙, 원리 그리고 공식이 존재합니다. 1884년, 프랑스 화학자 르 샤틀리에는 현대 화학 공법의 필수라고 하는 ‘화학 평형 이동의 법
www.chemi-in.com
05
산소와 질소의 분리로 ‘흡착’ 알아보기
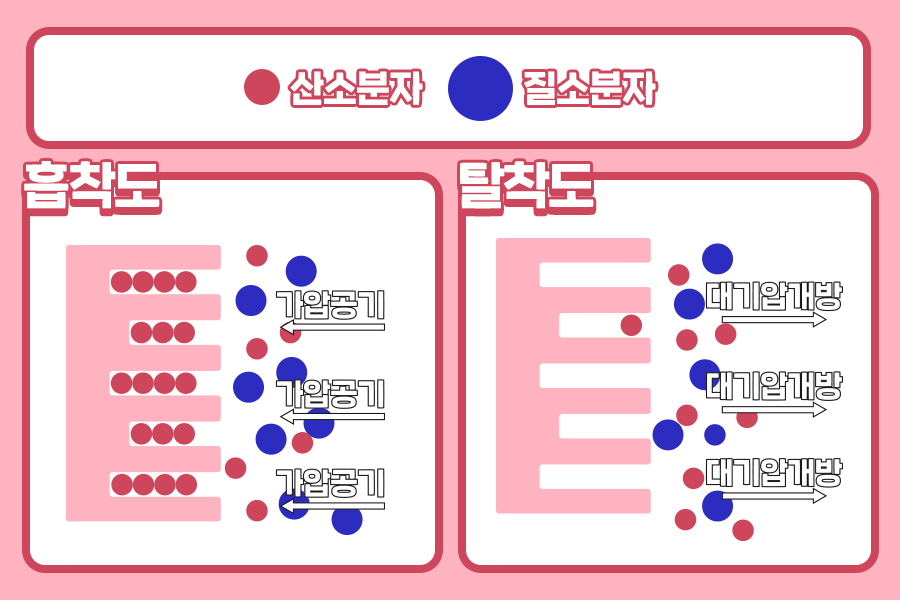
방금 우리는 흡착에 영향을 주는 요인에 대해 알아보았는데요, 공기에서의 산소와 질소 분리를 예시로 더 자세히 설명해 드리겠습니다.
산소분자는 질소분자에 비해 크기가 작습니다. 따라서 두 분자는 적절한 크기의 미세공을 가진 탄소분자체에 흡착될 때, 흡착 속도에서 차이를 보이죠. 위 그림을 한 번 살펴볼까요? 탄소분자체에 공기 압력을 가하면 크기가 큰 질소분자는 흡착하지 못하고 먼저 흘러나갑니다. 크기가 상대적으로 큰 산소분자는 흡착제에 붙어 머무르는데 말이죠.
이후, 압력을 대기압으로 낮추면 흡착제에 붙었던 산소가 떨어져 나오면서 산소와 질소를 분리할 수 있게 됩니다. 이렇게 압력을 변화시키며 흡착량 차이를 이용해 기체를 분리하는 공정을 PSA (Pressure Swing Adsorption) 공정이라고 합니다.
지금까지 흡착의 정의와 함께 흡착에 영향을 주는 요인을 간단한 예시와 함께 알아보았는데요. 우리의 일상에서도 많이 관찰할 수 있는 흡착과 그 원리가 모두 쉽게 이해되셨나요? 이번 이야기가 여러분에게 도움이 되었기를 바라며, 다음에는 더욱 알찬 내용으로 돌아오겠습니다!
(글: 한화토탈 공정연구팀 주영산 연구원)
종합 케미칼 & 에너지 리더,
한화토탈에 대해 더 알고 싶다면?
'ChemiLOG' 카테고리의 다른 글
| ‘설비’로 알아보는 석유화학 이야기 (0) | 2022.03.10 |
|---|---|
| 소중한 한 표를 위한 화학 (0) | 2022.03.04 |
| [월간 화학] 셀로판의 역사 (0) | 2022.02.24 |
| 앗 실수, 힝 속았지? 실수로 만들어진 화학 발명품 (0) | 2022.02.14 |
| February? Fe·Br·U·Ar·Y! (0) | 2022.02.08 |







