
안녕하세요? 블로그 지기입니다. 조금씩 추워지는 날씨와 함께 11월이 시작되었습니다. 11월하면 뭐니뭐니해도 ‘수능’이라는 빅 이벤트가 가장 먼저 생각이 나는데요. 수능에서도 화학이 빠질 수는 없죠. 오늘은, 화학 과목 중 빠지지 않는 법칙인 ‘헤스의 법칙’에 대해 같이 알아보겠습니다!
01
헤스의 법칙

스위스에서 태어나 러시아에서 자란 화학자 저메인 헨리 헤스(Germain Henri Hess). 그는 1840년 한 논문을 발표합니다. 훗날 헤스의 법칙(Hess' law)이라고 불리게 되는 이 논문에는 “화합물의 생성과 분해 등의 과정에서 발생하는 반응열은 일정하다”라는 주장이 담겨 있는데요. 쉽게 이야기하자면, A라는 물질에서 B라는 물질로 변화할 때 나오는 반응열은 A에서 C로, C에서 B로 변화할 때 나오는 반응열의 합과 같다는 것입니다. 다른 말로는 “총 열량 보존의 법칙”이라고도 하죠.
“고립된 계의 에너지는 일정하다” 라는 열역학 제1법칙에 익숙하신 분들은 헤스의 법칙이 당연한 이야기를 한다고 생각하실 수도 있습니다. 하지만 헤스의 법칙은 열역학 법칙보다 ‘먼저’ 발표되어 당시에는 매우 획기적인 생각이었다고 합니다.
02
모든 화학적 반응에는 ‘이것’이 있다!

헤스의 법칙을 잘 이해하기 위해서는 ‘반응열’에 대해 알아야 하는데요. 반응열이란 화학적 반응과 함께 방출 또는 흡수되는 에너지로 화학 반응의 에너지 크기를 계산하는 데 쓰입니다. 모든 화학적 변화에는 반응열이 뒤따르는 데요. 예를 들어 수소와 산소가 결합해 물이 되는 경우에도 반응열이 존재하고, 물이 얼어 얼음이 되거나 얼음이 녹아 물이 되는 경우에도 반응열이 존재합니다.
반응열은 총 다섯 가지가 있습니다. 어떤 물질 1몰(mol)*이 완전 연소할 때 발생하는 열량인 ‘연소열’, 화합물 1몰이 생성될 때 흡수하거나 발생하는 ‘생성열’, 반대로 화합물 1몰이 각각의 화학물질로 분해될 때 생기는 ‘분해열’이 있습니다. 그리고 산성/염기성이 중화되어 물 1몰을 생성할 때 나오는 ‘중화열’과 어떤 물질 1몰이 용매에 녹을 때 발생하는 ‘용해열’이 있죠.
각 반응열은 +KJ*, 혹은 –KJ로 표현됩니다. 예를 들어 탄소(C)와 산소(O) 2개가 만나 이산화탄소가 만들어지는 과정의 경우 생성열이 발생하는데요. 열이 주변으로 발산되기 때문에 C+O2=CO2+393.5KJ 으로 표현하게 됩니다. 반대로 질소(N)와 수소(H)가 만나 암모니아가 생성되는 과정에서는 주변의 열을 흡수하기 때문에 N2+3H2=2NH3-92.2KJ 라고 표현하죠.
*몰(mol): 분자를 뜻하는 몰큘(molecule)에서 나온 말로 원자, 분자, 이온 등 작은 입자를 계산할 때 사용하는 물질 단위.
*KJ(킬로줄): 화학 반응 중 일어나는 반응열을 계산하는 단위로 kJ/mol(몰)의 약자이다.
03
헤스의 법칙으로 반응열 계산하기

헤스의 법칙은 일종의 수학 영역이라고 할 수 있습니다. 반응물과 생성물이 같다면, 과정이 어떻든 최종 반응열은 같다는 원리를 이용해 계산을 하기 때문이죠. 반응열의 합과 차를 이용해 생성물과 반응물의 엔탈피 차이를 계산하는 것은 방정식과 같습니다. 다만 X와 Y 대신 화학물질을 사용하는 차이가 있죠. 헤스의 법칙은 복잡한 계산이 많지만 원리만 알면 풀 수 있는 것이 많습니다. 예시와 함께 자세히 알아볼까요?
암모니아(NH3)와 메탄(CH4)을 이용해 시안화수소(HCN)를 생성한다고 할 때 반응열은 얼마일까요? 우리에게 주어진 식은 아래와 같습니다.
① N2+ 3H2→ 2NH3 -92.2 kJ ⋯ 암모니아
② C(고체) + 2H2 → CH4 -74.7 kJ ⋯ 메탄
③ 2C(고체) + H2+ N2→ 2HCN+270.3 kJ ⋯ 시안화수소
먼저 메탄과 암모니아의 생성 과정과 반응열을 알아야 합니다.
①번식을 변형하면 2NH3 = N2+3H2+92.2 kJ 가 되고 ②번식을 변형하면 CH4 = C(고체)+2H2+74.7 kJ이 됩니다. 계산을 쉽게 하기 위해 ②번식에 2를 곱해주면2CH4 = 2C(고체)+4H2+149.4kJ로 표현할 수 있죠. 그 다음 메탄과 암모니아의 반응식을 더하면 2NH3+2CH4 = N2+7H2+2C(고체)+241.6KJ 이 됩니다.
앞서 말씀드린 것처럼 반응물=생성물±반응열이므로 ③번식 등호의 앞을 메탄과 암모니아가 든 식으로 치환하려면 메탄과 암모니아를 더한 반응식에서 “2C(고체)+H2+N2”을 남겨야 합니다. 반응식에서 6H2와 반응열을 이항하면
2NH3+2CH4= N2+7H2+2C(고체)+241.6KJ
-6H2 -241.6KJ+2NH3+2CH4= N2+H2+2C(고체)
고로 2C(고체)+H2+N2 = 2NH3+2CH4-6H2-241.6KJ와 같은 식으로 정리가 됩니다. 해당 식을 ③번식에 대입하면 2NH3+2CH4-6H2-241.6KJ = 2HCN+270.3KJ로 정리할 수 있고 계산하면 2NH3+2CH4 = 2HCN+6H2+511.9KJ이 됩니다.
즉 NH3+CH4= HCN+3H2+255.95KJ로 기화하는 수소(H2)를 제외하면 메탄과 암모니아가 결합해 시안화수소를 형성할 때 255.95KJ의 반응열이 나온다는 것을 알 수 있습니다.
04
헤스의 법칙은 어디에 쓰일까?
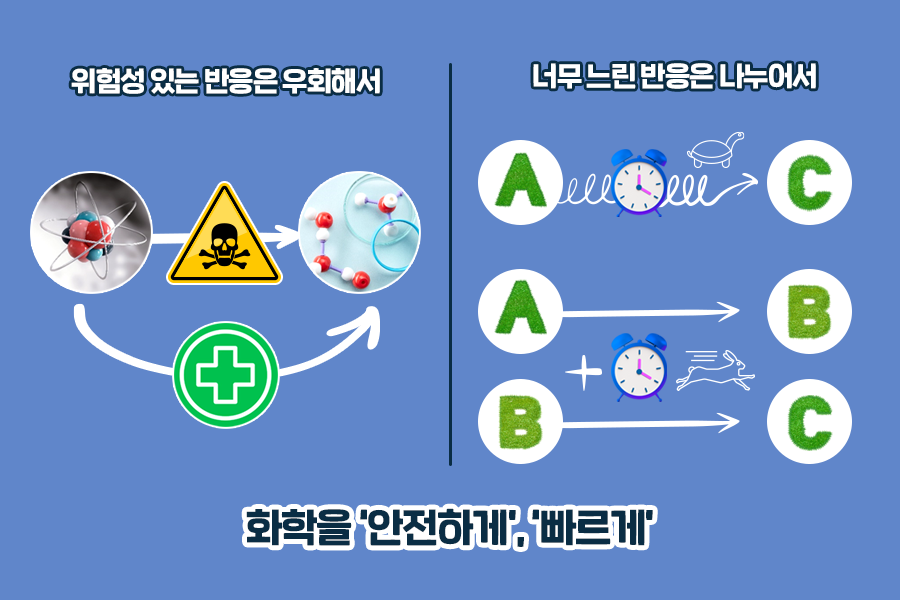
복잡한 식 때문에 머리가 아프신가요? 화학도 어려운데, 수학처럼 계산을 해야해서 더 헷갈리실 수도 있습니다. 하지만 화학 반응을 통해 유의미한 결과를 얻기 위해서는 헤스의 법칙을 필수로 알고 있어야 합니다. 헤스의 법칙은 화학 반응에 대한 반응열을 안전하게, 그리고 빠르게 계산할 수 있게 돕는 역할을 합니다.
먼저 화학 반응을 보다 안전하게 할 때 쓰입니다. 예를 들어 산화질소(NO)와 같은 불안정한 중간체의 반응열을 계산할 때 쓰입니다. 폭발이나 유해성이 있는 과정을 다른 화학 반응으로 우회해 반응열을 관찰할 수도 있습니다.
또한 헤스의 법칙은 주로 매우 느린 반응에서 나오는 반응열을 계산할 때 쓰입니다. 예를 들어 A에서 C로 변화하는 과정이 100년이 걸린다면 A에서 C로 변화하는 과정의 반응열도 100년에 걸쳐 계산해야 할 것입니다. 반면 이 과정을 A에서 B로, B에서 C로 변화하는 각각의 과정으로 나눈다면 어떨까요? 두 과정을 동시에 진행하면서 반응열을 계산하는 시간도 단축되겠죠. 중간에 어떤 단계를 거치든 각 반응열의 합은 최종 목적지인 C에서 나타나는 반응열과 같으니까요.
화학 반응에서 과정은 달라도 결과는 같다는 것을 알려준 헤스의 법칙. 수능에선 많은 학생들을 괴롭게 했죠. 하지만 우리는 헤스의 법칙 덕분에 다양한 방법을 생성해 낼 수 있었는데요. A에서 Z로 가기 위해 한 가지 방법이 아닌 만 가지 방법을 생각해 낼 수 있었죠. 수능도 마찬가지 일 것입니다. 하나의 방법으로 풀리지 않는 문제라면 여러가지 창의성 있는 풀이법을 찾아보세요. 정답이라는 결과를 향해 다양한 풀이를 생각하다보면, 분명 그 속에 숨은 정답을 발견하실 수 있을 것입니다. 결과는 같아도 과정은 여러가지인 ‘헤스의 법칙’을 기억하며, 수능 잘! 보시기 바랍니다. 언제나 그렇듯 여러분은 답을 찾을 것입니다!
종합 케미칼 & 에너지 리더,
한화토탈에너지스에 대해 더 알고 싶다면?
'ChemiLOG' 카테고리의 다른 글
| 모기 가고, 빈대 온다? 빈대 잡는 화학 (0) | 2023.12.07 |
|---|---|
| [케미툰] 붕어빵도 자동차도 석유화학과 함께! (0) | 2023.11.15 |
| 생산의 마지막이자 영업의 시작, 수지물류 (0) | 2023.10.30 |
| 로마의 황제, 옥타비아누스를 만든 화학 (0) | 2023.10.24 |
| [케미툰] 내가 쓰고 버린 비닐이 새로운 플라스틱으로? (0) | 2023.10.05 |








